II ФАЗА. AURORA
Мы исследовали эффективность и безопасность препарата у пациентов
с активным ревматоидным артритом. сравнили два режима дозирования —
1 раз в неделю и 1 раз в 2 недели, подкожно, 162 мг. оценили клиническую эффективность и безопасность терапии левилимабом на протяжении 52 недель исследования.
Детали исследования
Цели исследования
- Оценка терапевтической эффективности и безопасности левилимаба в двух режимах дозирования в сравнении с плацебо у пациентов с активным ревматоидным артритом
- Оценка эффективности, безопасности и иммуногенности левилимаба у больных активным РА при долгосрочном применении в двух режимах дозирования — 1 раз в неделю и 1 раз в 2 недели, подкожно, 162 мг, в сравнении с плацебо.
Популяция
105 пациентов с активным ревматоидным артритом. Женщины с активной стадией РА от 2 до 9 лет. Каждый пятый пациент ранее получал терапию генно-инженерными биологическими препаратами [1].
Подробные характеристики пациентовСхемы лечения
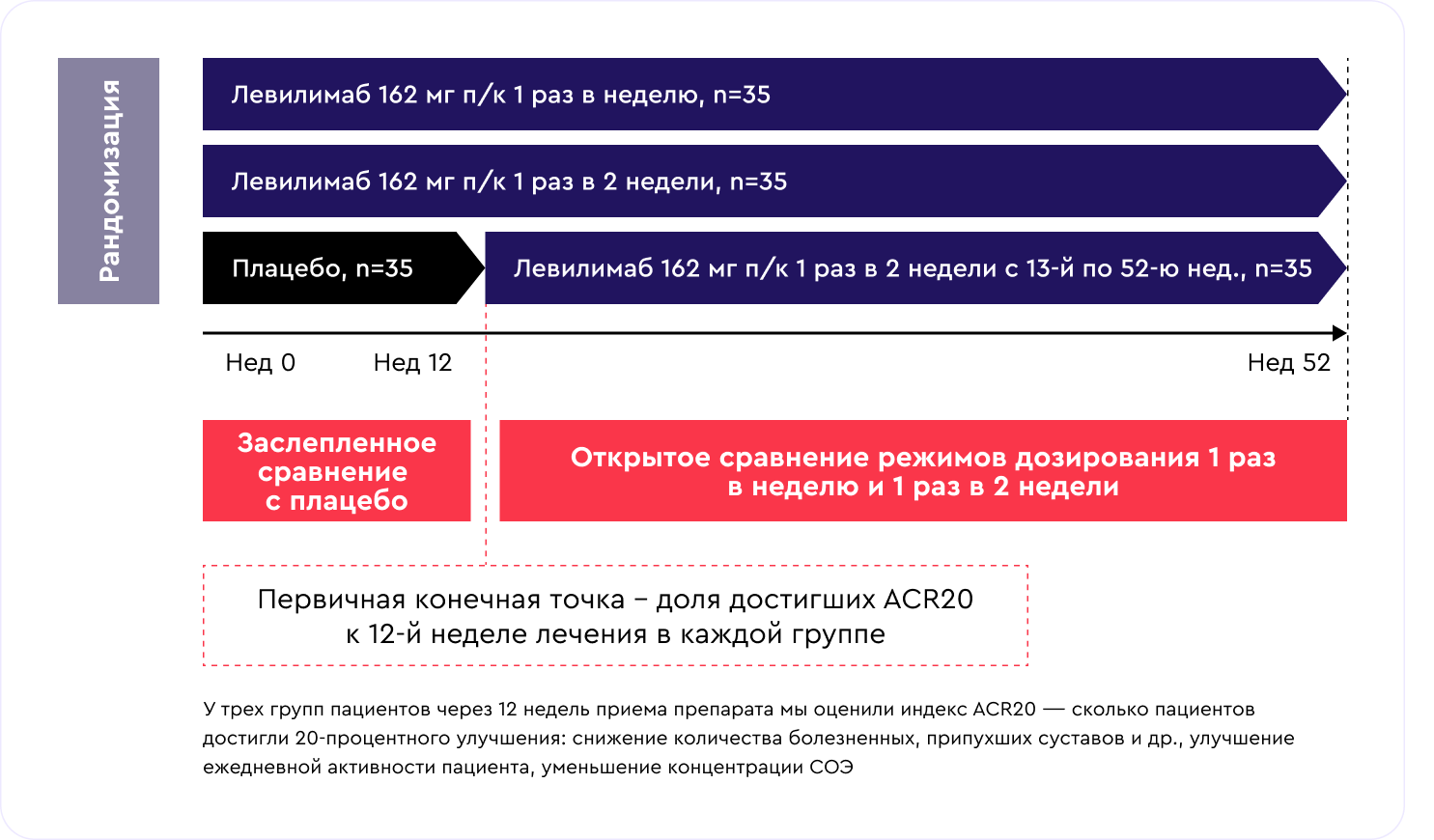
Пациенты с активным РА были распределены случайным образом в три группы:
- ЛВЛ подкожно 162 мг 1 раз в неделю, 35 человек;
- ЛВЛ подкожно 162 мг 1 раз в 2 недели, 35 человек;
- группа плацебо, 35 человек.
После оценки эффективности на 12-й неделе пациенты, которые принимали ЛВЛ, продолжили получать ЛВЛ открыто в тех же режимах. Пациенты группы плацебо были переведены на ЛВЛ 1 р/2 нед. Все пациенты получали метотрексат на протяжении всего исследования.
Первичная конечная точка исследования - достижение ответа ACR20 на неделе 12
Сколько пациентов через 12 недель Достигли 20-процентного улучшения по критериям ACR: снижение количества болезненных суставов, улучшение ежедневной активности пациента, уменьшение концентрации СОЭ и др.
Дополнительные критерии эффективности
- Оценка числа болезненных и припухших суставов, концентрации СОЭ и СРБ на 4, 8, 12, 16, 24, 36, 48, 52 неделях (индексы ACR20/50/70, DAS28–CRP, CDAI, SDAI).
- Оценка ремиссии по индексу Европейской противоревматической лиги и Американского колледжа ревматологов ACR/EULAR 2011 на 24, 36, 48, 52 неделях.
- Оценка качества жизни пациентом по опроснику SF36 на 24-й и 52-й неделях.
- Rg-прогрессия на 52-й неделе.
Оценка безопасности
Мы оценили, у скольких пациентов были нежелательные явления (НЯ), в том числе 3—4-й степени тяжести, и сколько пациентов из-за НЯ досрочно прекратили участие в исследовании. Мы оценивали НЯ, которые бывают при использовании ингибиторов рецептора ИЛ-6: повышение активности АЛТ/АСТ; лейкопения/нейтропения; тромбоцитопения; инфекции верхних дыхательных путей; флегмоны; пневмонии; инфекции, вызываемые Herpes Simplex 1-го типа и Herpes Zoster; дивертикулит; повышение общего холестерина /ЛПВП/ ЛПНП/триглицеридов [1].
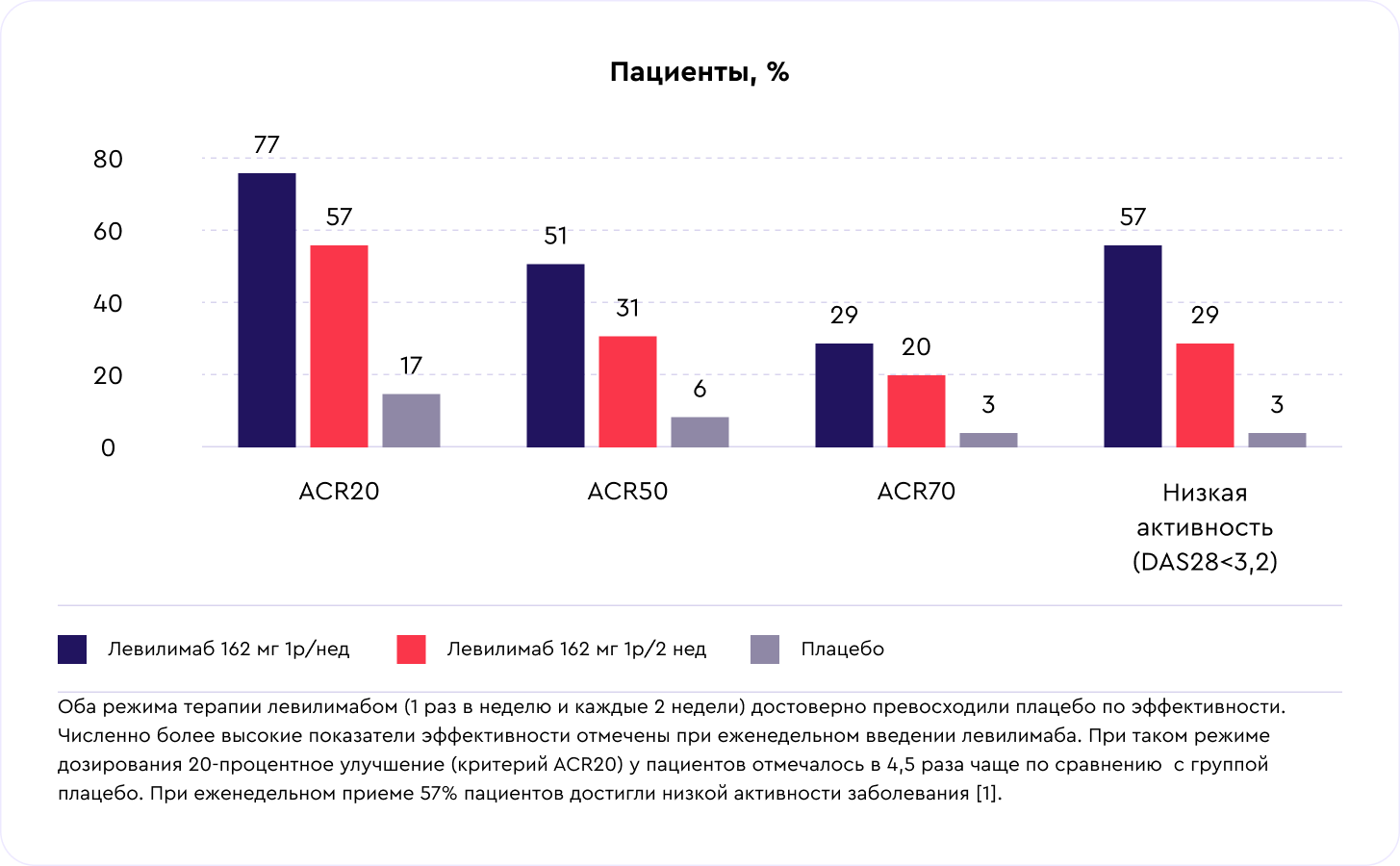
Результаты через 12 недель терапии
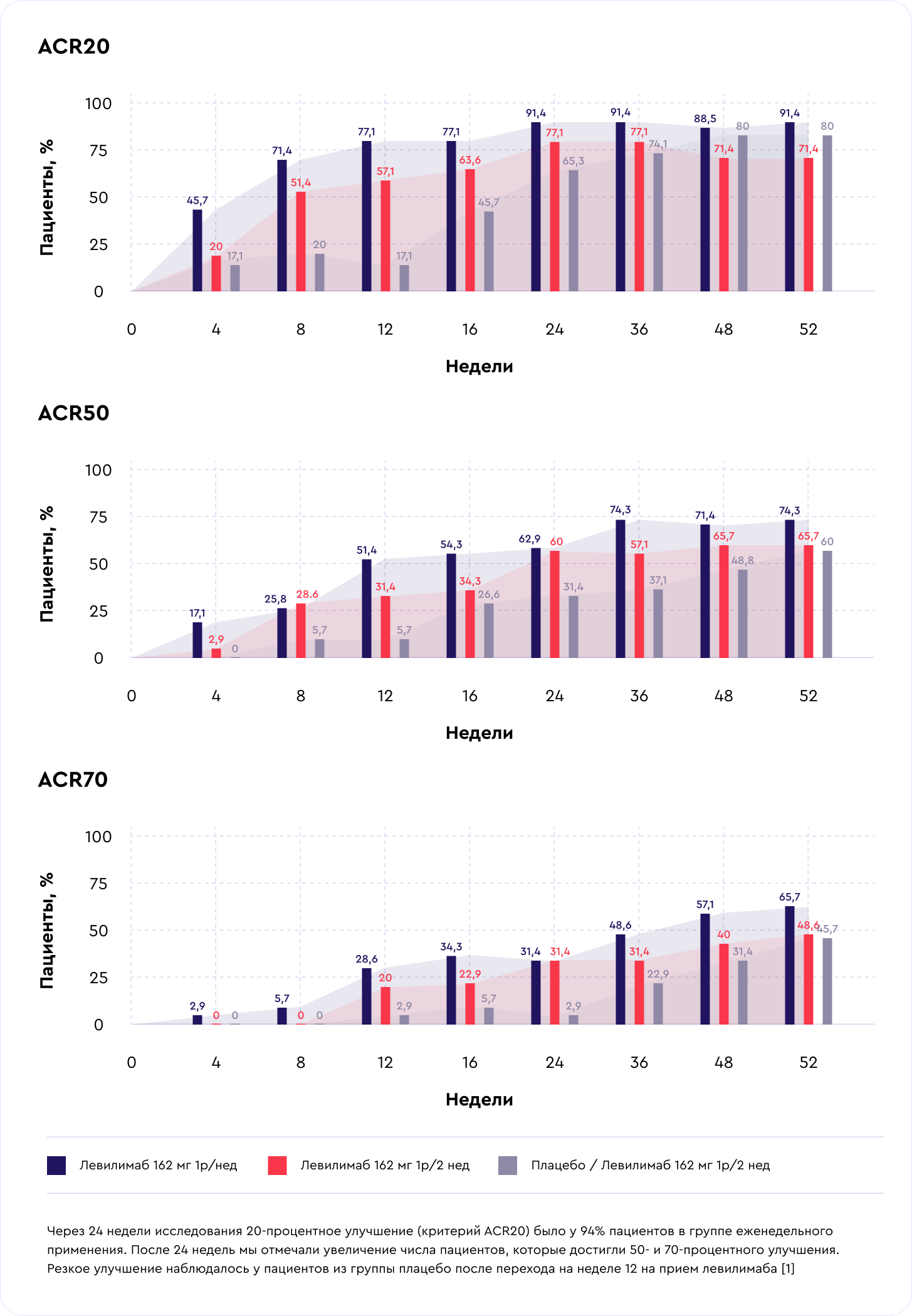
Результаты через 52 недели терапии
Безопасность препарата
Самые частые нежелательные явления — лабораторные отклонения: нейтропения, повышение уровней аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гиперхолестеринемия и повышение уровня триглицеридов. Нежелательные явления встречались у каждого третьего больного и были преимущественно 1—2-й степени тяжести. На первом месте среди всех нежелательных явлений было повышение общего холестерина. Антитела против левилимаба у пациентов не были выявлены ни в одной из временных точек [1].
Виды и частота нежелательных явлений в течение 52 недель исследованияИтоги II фазы клинического исследования препарата ИЛСИРА® (ЛЕВИЛИМАБ)
- Илсира® (левилимаб) показала высокую клиническую эффективность к 12-й неделе: 57% пациентов, которые принимали препарат 1 раз в неделю, достигли низкой активности заболевания (DAS28). К концу года исследования доля пациентов с улучшениями увеличивалась.
- Режим введения 1 раз в неделю показал наилучшее соотношение эффективности и безопасности.
- Безопасность терапии по видам и частоте нежелательных явлений не отличалась от профиля других ингибиторов рецептора ИЛ-6.
- Антитела на левилимаб у пациентов не были выявлены [1].
III ФАЗА. SOLAR
Мы исследовали эффективность и безопасность препарата у пациентов с ревматоидным артритом, которые устойчивы к монотерапии метатрексатом. До 24 недель мы оценивали результаты в сравнении с плацебо, с 24-й по 52-ю неделю проводили исследование в открытом режиме. пациенты, достигшие ремиссии РА на неделе 24, переводились на более редкий режим введения - 1 раз в 2 недели. Оценили снижение активности ревматоидного артрита, достижение ремиссии, лабораторные маркеры воспаления, рентгенологические изменения [2].
Детали исследования
Цели исследования
Подтвердить эффективность и безопасность препарата левилимаб в комбинации с метотрексатом у пациентов с активным ревматоидным артритом, которые устойчивы к монотерапии метотрексатом.
Популяция
154 пациента с активным ревматоидным артритом и неэффективностью терапии метотрексатом в течение последних 3 месяцев. Большинство пациентов ранее не имели опыта применения генно-инженерных биологических препаратов. У большинства РА был серопозитивным.
Системные проявления РА наблюдались у 24,5% пациентов в группе левилимаба и 30,8% пациентов в группе плацебо, чаще всего они были представлены анемией и ревматоидными узелками [1, 3].
Подробные характеристики пациентов: критерии заболевания, лабораторные показатели, анамнез приема препаратов:
в двойном слепом режиме исследованияв открытом режиме исследованияСхемы лечения
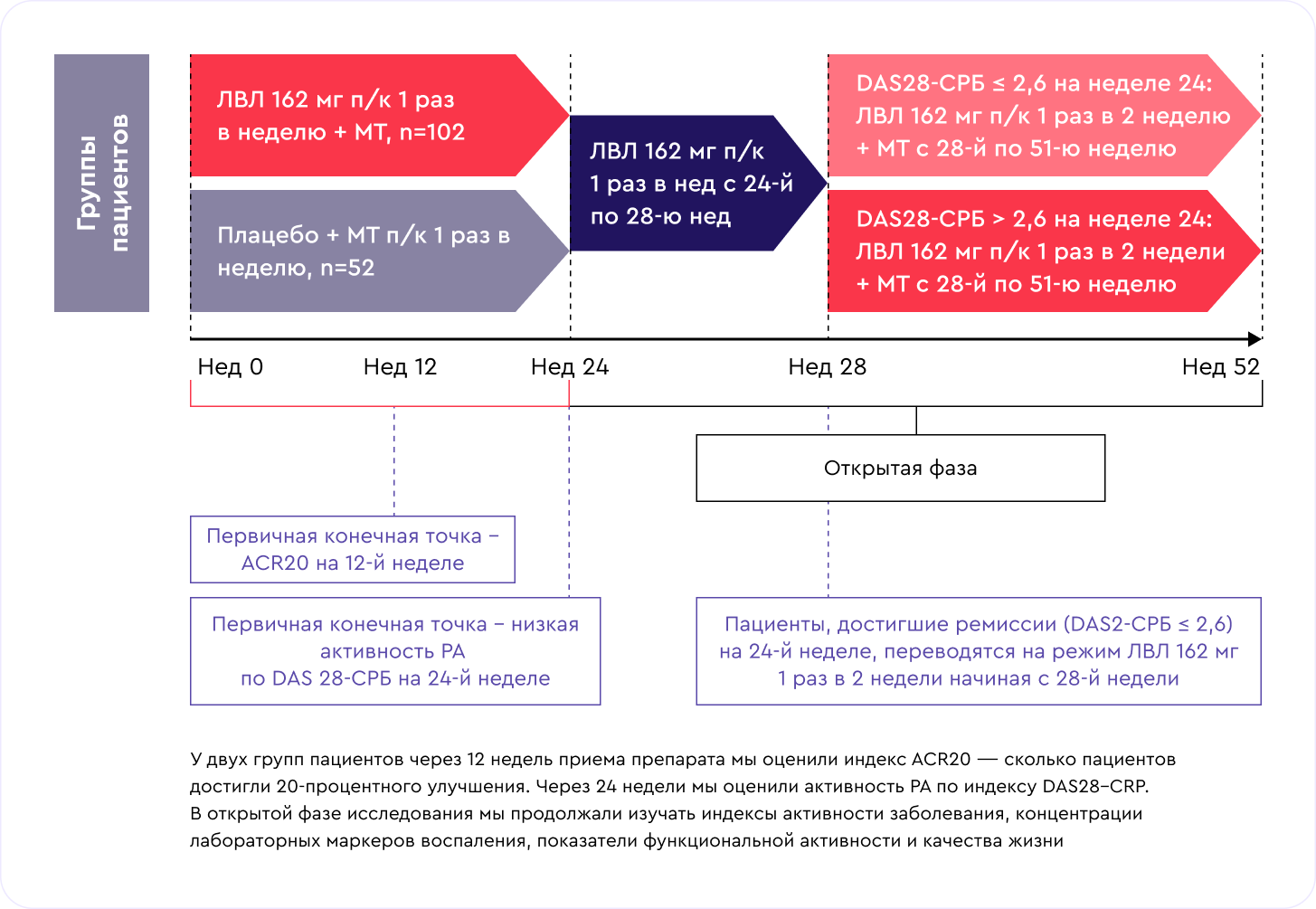
В двойном слепом сравнении с плацебо до 24 недель пациенты были распределены случайным образом в две группы:
- ЛВЛ подкожно 162 мг 1 раз в неделю, 102 человека;
- группа плацебо, 52 человека.
В открытом режиме пациенты были распределены в три группы:
- ЛВЛ подкожно 162 мг 1 раз в 2 недели, 27 человек — поддерживающий режим для пациентов, у которых на 24 неделе был зафиксирован наилучший ответ на терапию (критерий ремиссии DAS28-CRP ≤2,6);
- ЛВЛ подкожно 162 мг 1 раз в неделю, 75 человек, для пациентов, у которых на 24-й неделе исследования значения DAS28-CRP были более 2,6.
- ЛВЛ подкожно 162 мг 1 раз в неделю, 51 человек, для пациентов, которые до 24-й недели были в группе плацебо и у которых на 24-й неделе DAS28-CRP был более 2,6 [4].
Все пациенты получали метотрексат на протяжении всего исследования.
Первичные конечные точки исследования — ACR20 на неделе 12 и низкая активность РА по DAS28-CRP на неделе 24
Сколько пациентов Достигли 20-процентного улучшения на 12-й неделе по критериям DAS28-CRP: снижение количества болезненных суставов, улучшение ежедневной активности пациента, уменьшение концентрации СОЭ, а также сколько пациентов на 24-й неделе достигли низкой активности заболевания по критериям DAS28-CRP с учетом состояния 28 суставов.
Критерии эффективности в открытой фазе исследования
- Оценка 20-, 50-, 70-процентного улучшения (критерии ACR20, ACR50, ACR70) и достижения ремиссии и низкой активности РА по индексам активности DAS28, CDAI, SDAI.
- Динамика ответов по критериям Европейской противоревматической лиги (EULAR), опросникам оценки качества жизни SF-36, EQ-5D–3L и опросникам оценки усталости и общего здоровья (FACIT-F и HAQ-DI).
- Оценка рентгенологических изменений (счет Шарпа, стадия по Штейнброкеру).
Оценка безопасности
Мы оценивали, у скольких пациентов были:
- нежелательные явления (НЯ), в том числе 3—4-й степени тяжести, НЯ характерные для ингибиторов рецептора ИЛ-6: повышение активности АЛТ/АСТ; лейкопения/нейтропения; тромбоцитопения; инфекции; повышение общего холестерина /ЛПВП/ ЛПНП/триглицеридов;
- серьезные сердечно-сосудистые события: нефатальный инфаркт, нефатальный инсульт и сердечно-сосудистая смерть;
- местные реакции.
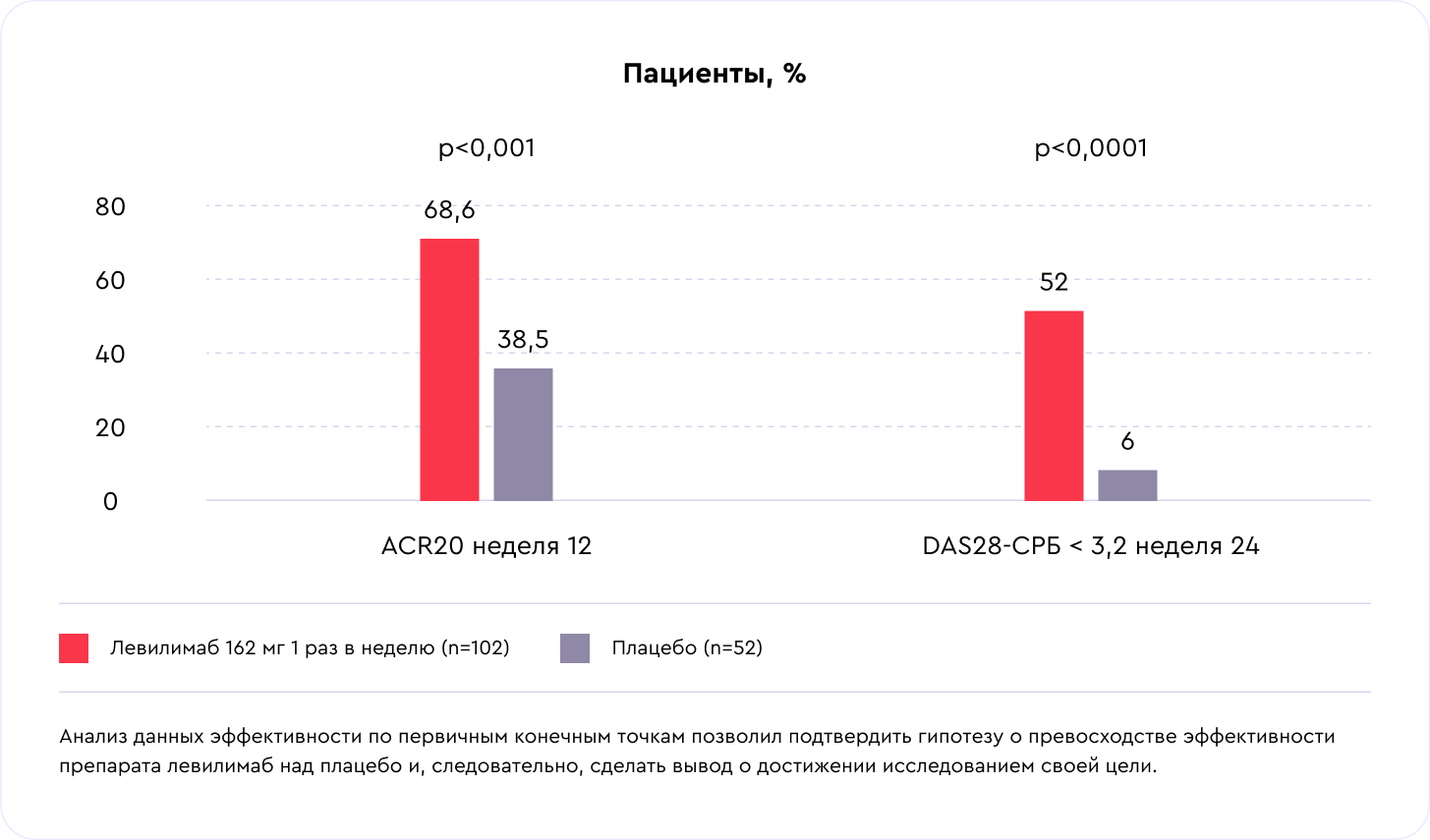
Результаты: улучшение, активность заболевания, ремиссия — критерии ACR20 и DAS28–CRP
Эффективность терапии нарастала на протяжении 52 недель исследования. Всего у половины пациентов из группы левилимаба на 24 неделе была низкая активность по критерию DAS28–CRP (<= 3,2). У 52% пациентов после 24 недель исследования была зафиксирована низкая активность РА по критериям DAS28-CRP. Высокие показатели 20-, 50- и 70-процентного улучшения были во всех группах исследования (критерии ACR20, ACR50, ACR70). В группе плацебо после перехода на прием левилимаба 70-процентное улучшение к 52-й неделе было зарегистрировано у 53% пациентов.
Пациенты из группы наилучшего ответа на терапию, которые продолжали прием левилимаба в поддерживающей дозе 1 раз в 2 неделе продолжали показывать высокие показатели по ремиссии. Более чем у 80% пациентов в этой группе сохранялась низкая активность заболевания и ремиссия по критериям DAS28–CRP, DAS28–CОЭ, CDAI, SDAI, ACR/EULAR 2011.
Пациенты, которые не достигли ремиссии за 24 недели и которые продолжали принимать левилимаб 1 раз в неделю, к 52-й неделе достигали хороших показателей ремиссии. К 52-й неделе 47% пациентов их этой группы достигли ремиссии по критерию DAS28–CRP и 61% по критерию DAS28–CОЭ.
Пациенты из группы плацебо, которые в открытом режиме исследования были переведены на прием левилимаба 1 раз в неделю, к 52-й неделе догоняли пациентов из других групп по показателям ремиссии. 48% пациентов в этой группе достигли ремиссии по критерию DAS28–CRP и 53% по критерию DAS28–CОЭ [4, 5, 6].
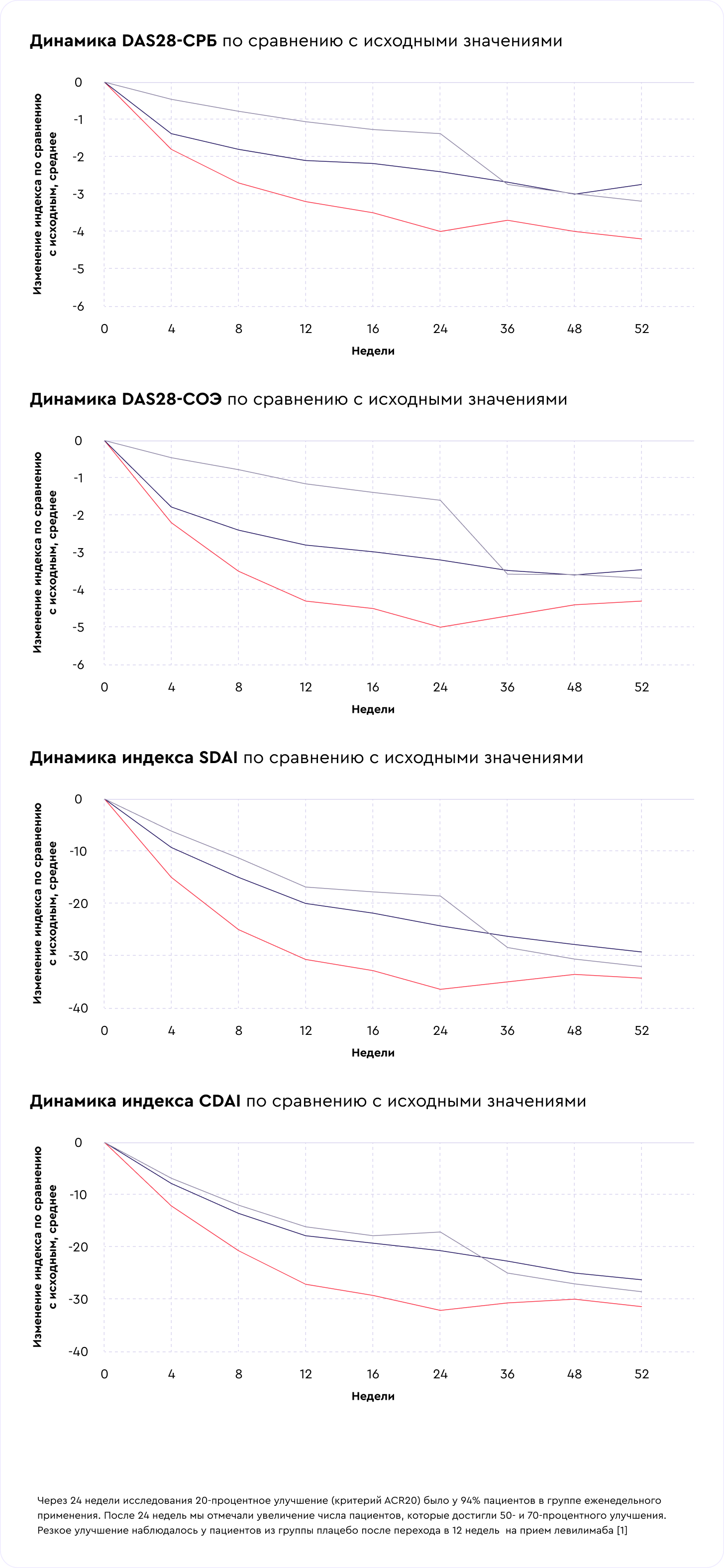
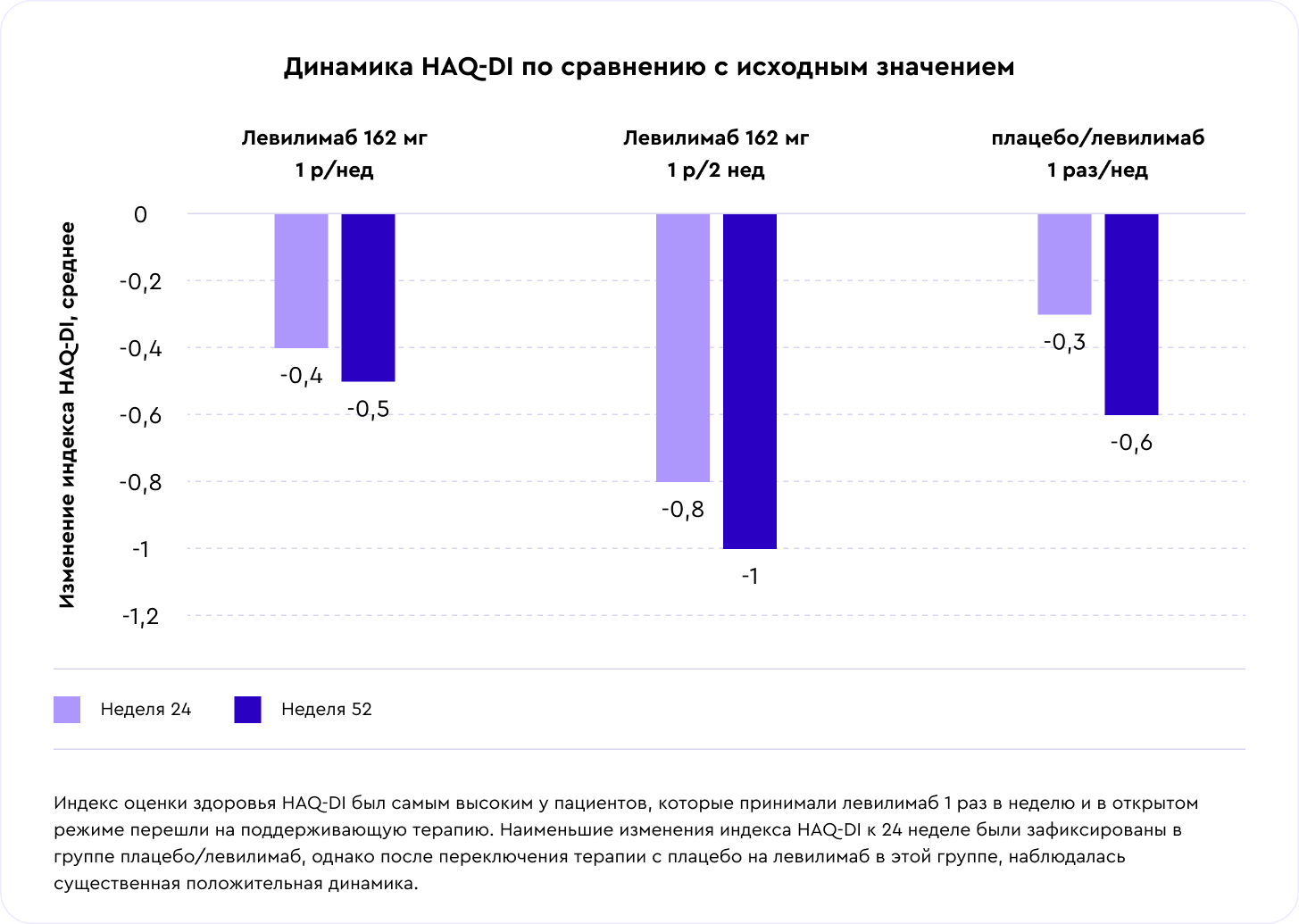
Результаты: оценка общего здоровья и качества жизни
Мы измеряли качество жизни, показатели усталости и нарушения жизнедеятельности по индексам и опросникам: SF-36, EQ-5D–3L, FACIT-F, HAQ-DI. Все показатели были лучше у пациентов в группе левилимаба. При оценке качества жизни по шкале EQ-5D-3L было выявлено улучшение качества жизни пациентов на фоне терапии левилимабом во всех группах, получавших левилимаб. Утомляемость у пациентов в группе левилимаба была ниже в 1,5 раза, чем в группе плацебо [7].
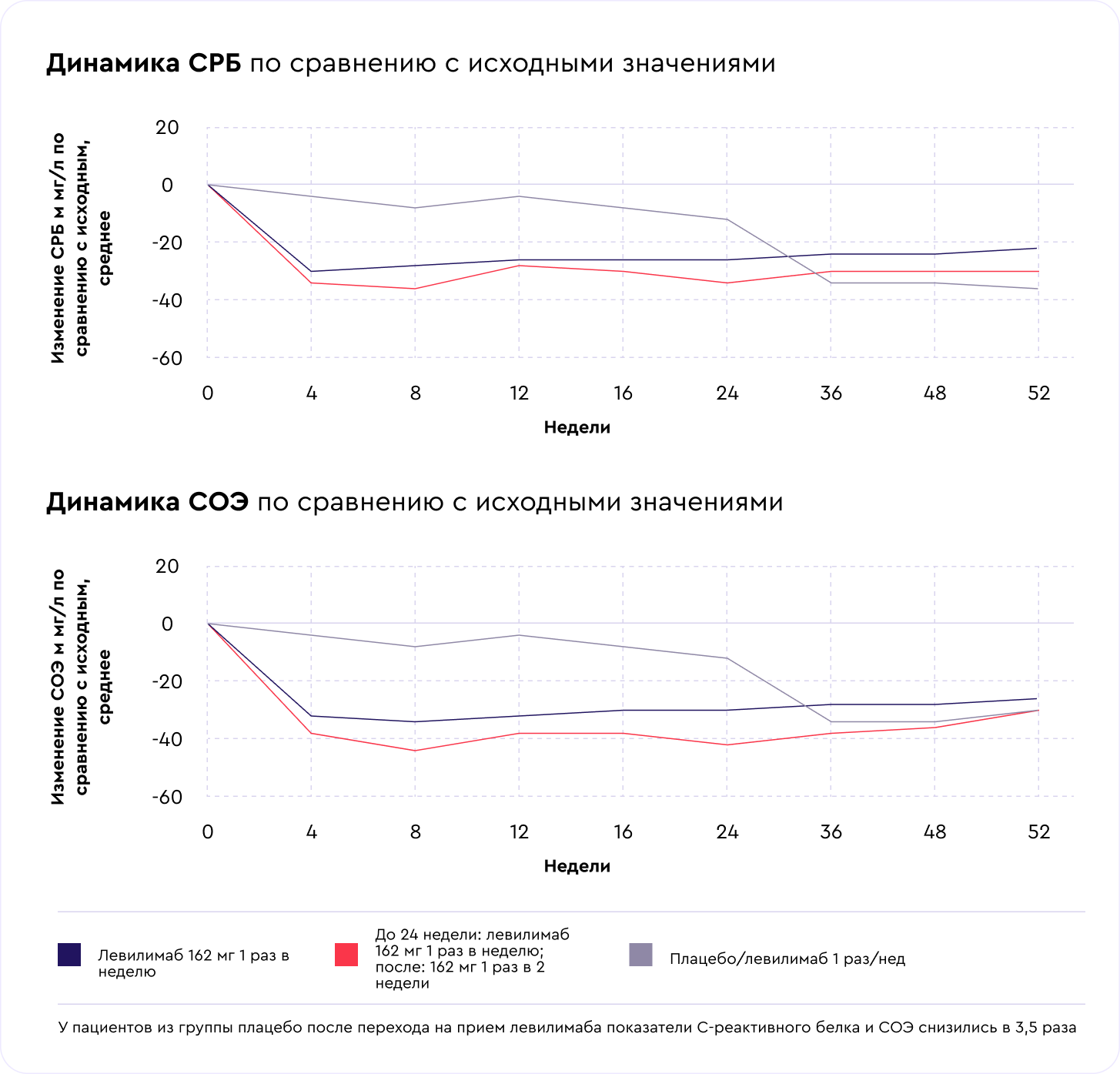
Результаты: лабораторные и рентгенологические показатели
Лабораторные маркеры воспаления (С-реактивный белок и СОЭ) в группе левилимаба достигли нормальных значений к 4-й неделе терапии и сохраняли значения до завершения исследования. В группе плацебо показатели С-реактивного белка и СОЭ были без существенных изменений до перехода на прием левилимаба в открытой фазе. После перехода значения маркеров воспаления у этой группы пациентов снизились до нормальных в течение 12 недель [3].
Рентгенологические признаки ревматоидного артрита были без отрицательной динамики у подавляющего числа пациентов во всех группах.
Безопасность препарата
Всего у 81,6% пациентов в ходе исследования были зарегистрированы нежелательные явления которые преимущественно были 1-2 ст. тяжести. Чаще всего были отклонения в лабораторных и инструментальных данных, инфекции и инвазии, реакции в месте введения. За весь период исследования серьезные нежелательные явления были у 6 человек. Летальных случаев не было. Связывающие антитела против левилимаба у пациентов не были выявлены [2].
Виды и частота нежелательных явлений в течение 52 недель исследованияИтоги III фазы клинического исследования препарата ИЛСИРА® (ЛЕВИЛИМАБ)
- Илсира показала высокую клиническую эффективность при лечении пациентов с активным РА. К 24-й неделе 52% пациентов достигли низкой активности (DAS28-СРБ<3,2), 22,5% — ремиссии заболевания (DAS28-СРБ<2,6). У пациентов нормализовались лабораторные маркеры воспаления и улучшились показатели функциональной активности и качества жизни.
- Пациентов, которые к 24-й неделе терапии достигли ремиссии, возможно перевести на поддерживающий режим левилимаба --- 162 мг п/к 1 раз в 2 недели.
- Продолжение терапии левилимабом у пациентов, которые не достигли ремиссии РА на 24-й неделе, помогает добиться более высоких показателей ремиссии и низкой активности РА к 52-й неделе терапии.
- Левилимаб обладает благоприятным профилем безопасности, соответствующим известным данным о препаратах группы ИЛ-6Р и низкой иммуногенностью.
- Мазуров В.И., Зоткин Е.Г., Гайдукова И.З., Иливанова Е.П., Кропотина Т.В., Плаксина Т.В., Несмеянова О.Б., Сорока Н.Ф., Кундер Е.А., Докукина Е.А., Линькова Ю.Н., Кравцова Н.А., Пухтинская П.С., Еремеева А.В., Зинкина-Орихан А.В., Луцкий А.А. Эффективность и безопасность применения левилимаба в комбинации с метотрексатом у пациентов с ревматоидным артритом: результаты II фазы исследования AURORA. Научно-практическая ревматология. 2021;59(2):141–151.
- Мазуров В.И., Королев М.А., Пристром А.М. и др. Эффективность и безопасность левилимаба в сочетании с метотрексатом при лечении пациентов с активным ревматоидным артритом, устойчивым к монотерапии метотрексатом (двойное слепое рандомизированное плацебо-контролируемое исследование III фазы, SOLAR). Современная ревматология. 2021;15(4):13–23. DOI: 10.14412/1996-7012-2021-4-13-23.
- Отчет о клиническом исследовании BCD-089-3/SOLAR. Дата составления отчета 15.03.2021. Мазуров В.И., Королев М.А., Пристром А.М. и др. Эффективность и безопасность левилимаба в сочетании с метотрексатом при лечении пациентов с активным ревматоидным артритом, устойчивым к монотерапии метотрексатом (двойное слепое рандомизированное плацебо-контролируемое исследование III фазы, SOLAR).
- Общая информация о препарате соответствует инструкции по медицинскому применению препарата ИЛСИРА® (левилимаб), ЛП-006244 от 05.06.2020, Государственный реестр лекарственных средств https://grls.rosminzdrav.ru
- Современная ревматология. 2021;15(4):13–23. DOI: 10.14412/1996-7012-2021-4-13-23
- Mazurov V., Korolev M., Kundzer A., et al. POS0624 EFFICACY AND SAFETY OF LEVILIMAB IN COMBINATION WITH METHOTREXATE IN SUBJECTS WITH ACTIVE RHEUMATOID ARTHRITIS: PHASE III, DOUBLE-BLIND, PLACEBOCONTROLLED, RANDOMIZED TRIALAnnals of the Rheumatic Diseases 2021;80:550-551.
- Мазуров ВИ, Лила АМ, Королев МА, и др. Научно-практическая ревматология. 2023;61(1):87–99.